Les infections gastro-intestinales parasitaires chez les enfants immigrants et réfugiés
Faits saillants
- Les infections par la Giardia, les géohelminthiases (des vers) (p. ex., les nématodes [Ascaris], les trichocéphales [Trichuris] et les ankylostomes) et les parasites des espèces de Strongyloides et de Schistosoma font partie des infections les plus courantes au sein des populations de réfugiés.
- Bien qu’elles soient souvent asymptomatiques ou subcliniques, ces infections peuvent également provoquer de graves maladies, et même des décès.
- Il est recommandé de faire des tests sérologiques pour dépister les espèces de Schistosoma chez les nouveaux réfugiés et immigrants en provenance de régions endémiques, telles que l’Afrique. Si les résultats sont positifs, le traitement est recommandé, même chez les enfants asymptomatiques.
- Il est recommandé de faire des tests sérologiques pour dépister le Strongyloides stercoralis chez les nouveaux réfugiés et immigrants provenance de régions endémiques, telles que l’Asie du Sud-Est et l’Afrique. Si les résultats sont positifs, le traitement est recommandé, même chez les enfants asymptomatiques.
Les nématodes
| Figure 1. Œuf d’Ascaris (nématode) et ver femelle adulte |
 |
|
Source : Orange County Public Health |
Les nématodes intestinaux sont transmis aux humains par l’une des deux voies suivantes :
- Ingestion de terre contaminée par des œufs infectés (p. ex., nématode et trichocéphale [A. lumbricoides, T. trichiura])
- Pénétration de la peau par des larves infectées (p. ex., ankylostomes [Ancylostoma duodenale et Necator americanus] et S. stercoralis)
Infection par les géohelminthiases (nématode, trichocéphale, ankylostome)
La répartition
La base de données sur la chimioprévention et la lutte contre la transmission de l’OMS présente, en anglais, des données sur la répartition mondiale des géohelminthiases.
| Figure 2. Œuf de Trichuris (trichocéphale) et ver femelle adulte |
 |
| Source : Centers for Disease Control and Prevention. DPDx, Public Heath Image Library (PHIL). |
La morbidité
- La plupart des pathologies liées aux géohelminthiases sont causées par la charge parasitaire, qui diminue rapidement après qu’une personne quitte une région endémique, car ces nématodes ont une durée de vie relativement courte. Les personnes dont la charge parasitaire est faible sont généralement asymptomatiques. En cas de charge plus importante, on peut constater une diarrhée, des douleurs abdominales, une distension abdominale et un malaise généralisé1.
- L’infection par des parasites gastro-intestinaux peut provoquer une malabsorption, une malnutrition associée à un retard de croissance et une anémie chronique qui peuvent nuire au développement physique et cognitif de l’enfant.
| Type de morbidité | Signe de morbidité | Parasite |
|---|---|---|
| Trouble nutritionnel | Saignement intestinal, anémie |
Ancylostoma duodenale |
| Malabsorption des nutriments | Ascaris lumbricoides | |
| Compétition pour les micronutriments | A. lumbricoides | |
| Trouble de la croissance | A. lumbricoides | |
| Perte d’appétit et réduction de la prise alimentaire | A. lumbricoides | |
| Diarrhée ou dysenterie | Trichuris trichiura | |
| Trouble cognitif | Limitation du langage et baisse de la mémoire | T. trichiura |
| Pathologies nécessitant une intervention chirurgicale | Obstructions intestinales et biliaires | A. lumbricoides |
| Prolapsus rectal | T. trichiura | |
|
Source : Reproduction autorisée d’Agir pour réduire l’impact mondial des maladies tropicales négligées : premier rapport de l’OMS sur les maladies négligées. Genève, Organisation mondiale de la Santé, 2011, page 139. Montresor A et coll. Helminth control in school age children. A guide for managers of control programmes, Genève : OMS, 2010. |
||
Le diagnostic
Il faut examiner au moins deux échantillons de selle recueillis des jours différents dans un agent de conservation afin d’y déceler des œufs et des parasites2. Dans une étude auprès d’enfants adoptés à l’étranger, chez les 194 enfants qui présentaient un pathogène et qui avaient soumis trois échantillons de selle, la probabilité de dépister un parasite s’élevait à 79 % après le test d’un échantillon, à 92 % après le test de deux échantillons et à 100 % après le test de trois échantillons3. Les tests de dépistage des antigènes ne suffisent pas, mais doivent s’associer à une coloration permanente et à une coloration acido-résistante4,5. L’absence de vers dans les selles ne permet pas d’écarter certaines infections (voir le Strongyloides, ci-dessous). Si vous craignez la présence d’un parasite précis en raison de l’histoire, de l’épidémiologie ou des résultats de l’examen physique, il est utile de préciser le nom du parasite sur la demande d’analyse. Un laboratoire de microbiologie ayant de l’expérience dans l’identification des parasites, tels que le Laboratoire de santé publique, peut avoir accès à d’autres tests diagnostiques spécialisés.
Le Strongyloides stercoralis
La répartition
On estime que 100 millions de personnes dans le monde sont atteintes d’une infection chronique par le S. stercoralis. Une enquête sérologique a révélé une prévalence de 11 % à 69 % auprès des populations de réfugiés6. La Collaboration canadienne pour la santé des immigrants et des réfugiés (CCSIR) a mené une analyse complète et conclu que les immigrants d’Asie du Sud-Est et d’Afrique devraient subir un dépistage7. Le site Web des CDC présente de l’information, en anglais, sur le cycle de vie du S. stercoralis.
La morbidité
La plupart des infections par le Strongyloides sont asymptomatiques. Les larves infectieuses (filariformes), acquises par contact cutané avec de la terre contaminée, peuvent produire des papules prurigineuses transitoires au foyer de pénétration8. Les larves qui migrent jusqu’aux poumons peuvent provoquer une pneumonite transitoire associée à une éosinophilie (syndrome de Lœffler). Une éosinophilie inexpliquée (numération des éosinophiles sanguins supérieure à 500/mL) peut être la seule observation à la présentation, mais l’éosinophilie peut disparaître plus tard en cas d’infection chronique. Après avoir remonté l’arbre trachéobronchique, les larves sont avalées, puis deviennent adultes dans le tractus gastro-intestinal. Les symptômes incluent des douleurs abdominales non spécifiques, des vomissements et une diarrhée aqueuse contenant du mucus. L’anorexie et la malabsorption peuvent entraîner un retard staturopondéral chez les enfants. La migration des larves à partir des organismes qui quittent l’anus peut provoquer la formation de cordons serpigineux et érythémateux dans la région périanale, les fesses et le haut des cuisses8,9.
Contrairement au nématode, au trichocéphale et à l’ankylostome, le Strongyloides peut « s’auto-infecter » ou se répliquer et maintenir son cycle de vie dans un individu. Une infection subclinique ou légère peut persister et provoquer une grave morbidité ou un décès des décennies après que la personne a quitté la région endémique10.
L’auto-infection peut produire des milliers de parasites adultes dans l’intestin ou un « syndrome d’hyperinfection »8. L’hyperinfection peut entraîner une infection disséminée lorsque les larves passent par la circulation systémique pour migrer dans d’autres organes, y compris le cerveau, le foie, le cœur et la peau. Par conséquent, les larves peuvent se trouver dans les expectorations ou le liquide céphalorachidien9. L’hyperinfection ou la maladie disséminée se caractérise par de la fièvre, une douleur abdominale, des infiltrats pulmonaires diffus et une septicémie ou une méningite causée par des bâtonnets Gram négatif d’origine entérique9. Les patients immunodéprimés sont plus à risque de dissémination et de décès. En général, ce sont des personnes :
- qui prennent des glucocorticoïdes en raison d’un cancer ou d’une maladie auto-immune,
- qui prennent des immunomodulateurs,
- qui sont infectées par le virus T-lymphotropique humain de type 1 (HTLV-1),
- qui souffrent de grave malnutrition8,9.
| Figure 3. Ankylostome (à gauche) et larve filariforme Strongyloides au stade infectieux (à droite) |
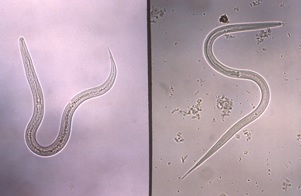 |
| Source : Centers for Disease Control and Prevention. Public Heath Image Library (PHIL). Docteure Mae Melvin. |
Le diagnostic
L’excrétion des larves dans les selles est très variable8. Trois prélèvements consécutifs de selles examinés au microscope pour déceler des larves (et non des œufs) caractéristiques ont une sensibilité de moins de 60 %. La sensibilité passe à plus de 90 % lorsque sept échantillons sont examinés6. Les tests sérologiques, plus sensibles que la microscopie des selles, sont favorisés. Le Centre de référence national en parasitologie de Montréal effectue les tests sérologiques du Strongyloides.
Qui devrait subir le dépistage?
La Collaboration canadienne pour la santé des immigrants et des réfugiés10, les Centres for Disease Control and Prevention des États-Unis et l’Australasian Society for Infectious Diseases recommandent d’effectuer des tests sérologiques pour dépister les nouveaux réfugiés de tout âge en provenance de régions du monde où la strongyloïdiose est hautement endémique.
Puisque les complications du syndrome d’hyperinfection peuvent être fatales, il faut également effectuer des tests sérologiques auprès de tout immigrant en provenance d’une région endémique avant qu’il commence un traitement immunosuppresseur ou au moment du diagnostic de maladie immunitaire.
Puisque l’éosinophilie (numération des éosinophiles sanguins supérieure à 500/mL) peut être un signe de strongyloïdiose, il est essentiel d’obtenir un diagnostic sérologique chez toutes les personnes de pays en développement qui ont une éosinophilie inexpliquée8.
Le traitement
Il est recommandé de consulter un pédiatre spécialisé en maladies infectieuses ou en maladies tropicales avant d’amorcer un traitement à l’ivermectine ou à l’albendazole.
L’ivermectine, le traitement de première intention de la strongyloïdiose chronique (asymptomatique) et de l’hyperinfection par la maladie disséminée8, peut seulement être obtenue par l’entremise du Programme d’accès spécial de Santé Canada. Comme le traitement à l’albendazole ou au thiabendazole s’associe à des taux de guérison plus faibles, il est recommandé seulement en cas de contre-indications de l’ivermectine. Il peut être nécessaire de prolonger ou de reprendre le traitement chez les personnes atteintes d’une hyperinfection et d’une strongyloïdiose disséminée. De plus, les récidives sont possibles. En cas de strongyloïdiose disséminée, les antibiotiques à large spectre sont indiqués pour le traitement des complications bactériennes secondaires comme la sepsis ou la méningite. Voir le tableau 2 pour obtenir de l’information sur le traitement.
Le pronostic est excellent chez les patients qui sont traités rapidement, mais le taux de mortalité de l’infection disséminée dépasse les 50 %6.
Le Programme d’accès spécial de Santé Canada
Auprès du PAS, le Programme d’accès spécial de Santé Canada, les praticiens peuvent obtenir des médicaments qui ne sont pas vendus au Canada. Grâce à ce programme, des patients ayant de graves pathologies ont accès à des traitements d’urgence. Pour en savoir plus et obtenir les formulaires, consulter le site Web de Santé Canada.
| Parasite intestinal | Traitement suggéré pour les enfants et les adolescents |
|---|---|
|
Nématodes |
|
|
Oxyures |
|
|
Ankylostomes |
|
|
Strongyloïdiose |
|
|
Trichocéphale |
|
|
*Non homologué au Canada, mais peut être commandé par l’entremise du Programme d’accès spécial de Santé Canada8,11,12. |
|
Les douves (trématodes)
Les douves désignent un groupe de parasites dont le cycle de vie passe par un hôte, l’escargot d’eau douce, pour se disséminer. Les douves du sang infectent les humains en pénétrant les surfaces cutanées, tandis que les douves d’origine alimentaire infectent les humains par l’ingestion de certains aliments. Comme ils envahissent les tissus, tous les trématodes ont tendance à provoquer une éosinophilie.
La schistosomiase (autrefois appelée bilharziose)
La schistosomiase est une maladie parasitaire aiguë et chronique causée par des douves du sang du genre Schistosoma13. La plupart des schistosomiases humaines sont attribuables au S. haematobium, au S. mansoni et au S. japonicum. Le S. intercalatum et le S. mekongi sont des espèces moins courantes. Le site Web des CDC présente de l’information, en anglais, sur le cycle de vie de la schistosomiase.
La répartition
Quelque 700 millions de gens provenant de 78 pays sont vulnérables à la schistosomiase, tandis que 240 millions seraient infectés(14). On estime que 200 000 décès sont liés à cette infection chaque année en Afrique subsaharienne, dont tous les pays sont considérés comme endémiques, sauf le Lesotho. Le S. mansoni et le S. haematobium sont les principaux trématodes chez les réfugiés nouvellement arrivés au Canada. Leur prévalence, qui se situe entre 15 % et 46 %, est élevée en Afrique subsaharienne6.
| Figure 4. La répartition géographique des schistosomiases |
 |
|
Source : Traduction autorisée de l’éditeur, extraite de la galerie de cartes de l’Observatoire mondial sur la santé de l’Organisation mondiale de la Santé, consultée le 16 décembre 2014 |
L’étiologie et la présentation
Les nourrissons peuvent être infectés par la schistosomiase lorsqu’ils accompagnent leur mère à un lac et à d’autres sources d’eau douce. L’absence d’hygiène et la nage ou la pêche dans les lacs infestés rendent les enfants d’âge scolaire particulièrement vulnérables à d’importantes infections. Les barrages, les systèmes d’irrigation et la migration accrue dans les régions urbaines favorisent la transmission dans de nouvelles régions15.
Les gens sont infectés lorsque des formes larvaires du parasite, libérées par des escargots d’eau douce, pénètrent dans la peau. On peut observer une éruption papuleuse, prurigineuse et transitoire. Les organismes pénètrent ensuite dans le sang, passent par les poumons pour migrer vers le plexus veineux qui draine les intestins (S. mansoni et S. japonicum) ou la vessie (S. haematobium), où les vers adultes vivent en moyenne de trois à cinq ans16, mais peuvent atteindre 30 ans13. Les vers femelles produisent des centaines (S. mansoni et S. haematobium), voire des milliers (S. japonicum) d’œufs par jour13. Certains œufs sont expulsés dans les selles ou les urines, mais d’autres restent coincés dans les tissus et provoquent des réactions immunitaires et des lésions progressives des organes.
La schistosomiase aiguë (ou maladie de Katayama) est une réaction d’hypersensibilité systémique qui se produit lorsque la femelle commence à produire des œufs. Ce processus peut s’amorcer de deux à 12 semaines après l’exposition16. On peut observer de la fièvre, des malaises, une éruption cutanée, une lymphadénopathie, une toux, des râles, une anorexie, des douleurs abdominales, une diarrhée sanguinolente, une hépatomégalie sensible et une légère splénomégalie. L’éosinophilie est fréquente. En général, la maladie guérit au bout de deux à quatre semaines, mais elle peut également entraîner des décès.
La plupart des enfants atteints d’une schistosomiase intestinale sont asymptomatiques13. Les enfants qui hébergent plus de vers peuvent présenter une anorexie, des malaises et un sentiment de plénitude abdominale. L’entéropathie exsudative et la perte entérique de sang peuvent entraîner une malnutrition et une anémie ferriprive, un retard de croissance et une altération du développement cognitif17. Les complications au potentiel fatal causées par le S. japonicum et le S. mansoni sont attribuables aux œufs qui restent dans le réseau veineux et migrent dans le foie, ce qui précipite une fibrose et une hypertension portale (p. ex. hépatosplénomégalie, ascites et varices œsophagiennes)16. Chez les adolescents et les adultes, les décès découlent souvent de saignements gastro-intestinaux. En général, la fonction hépatocellulaire est préservée. L’ictère et l’élévation des enzymes hépatiques sont inhabituels9.
La schistosomiase urogénitale (S. haematobium) peut être responsable d’une fibrose vésicale. L’hématurie terminale fait son apparition lorsque la vessie enflammée se contracte pendant la miction, mais disparaît généralement entre l’âge de 12 et 15 ans. Des cas d’infections urinaires récurrentes et de syndrome néphrotique sont signalés(16). L’hydronéphrose, les calculs vésicaux, le cancer de la vessie et l’insuffisance rénale sont plus fréquents chez les adultes que chez les enfants. La schistosomiase urogénitale est un facteur de risque d’infection par le VIH, particulièrement chez les femmes18,19.
Les œufs peuvent s’emboliser :
- jusqu’aux poumons, causant ainsi un cœur pulmonaire,
- jusqu’à la moelle épinière (S. mansoni ou S. haematobium) et entraîner une myélite transverse.
- jusqu’au cerveau (particulièrement le S. japonicum) et précipiter des convulsions.
Qui devrait subir le dépistage?
Une démarche raisonnable consiste à dépister tous les enfants, y compris ceux qui sont asymptomatiques, qui reviennent ou émigrent d’une région où la schistosomiase est endémique, notamment s’ils risquent d’avoir été exposés à de l’eau douce9. En général, la pathologie est surtout inflammatoire chez les enfants et se résorbe à l’aide d’un traitement. Cependant, une fibrose hépatique avancée ou une grave néphropathie peut être irréversible13.
Le diagnostic
Pour diagnostiquer la schistosomiase, il faut déceler des œufs dans des échantillons de selles ou d’urine ou bien des anticorps ou des antigènes dans des prélèvements de sang ou d’urine13. Les études habituelles des selles ne sont pas aussi sensibles à la schistosomiase qu’aux géohelminthiases6. Il est recommandé de prélever trois échantillons d’urine (dans les régions où le S. haematobium est endémique) ou de selles (dans les régions où le S. mansoni ou le S. japonicum est endémique) trois jours différents6. L’excrétion d’œufs dans les urines aura plus de chances d’être positive en fin de miction, entre midi et 15 h. On peut observer une hématurie6. Des études des selles au microscope en vue de déceler la schistosomiase dans les populations de réfugiés africains ont rendu compte d’une prévalence de 0,4 % à 7 %. Les tests sérologiques spécifiques peuvent être particulièrement utiles pour déceler des infections bénignes20. Les études faisant appel à une épreuve immunoenzymatique sérologique révèlent une prévalence considérablement plus élevée, qui se situe entre 2,2 % dans les populations d’âge pédiatrique d’Afrique de l’Est et 64 % à 73 % chez les réfugiés soudanais et somaliens, respectivement10. Tant les CDC que l’Australasian Society for Infectious Diseases préconisent l’utilisation de tests sérologiques pour dépister la schistosomiase.
Une échographie du système urinaire s’impose chez tout enfant infecté par le S. hematobium9. Si la situation clinique l’indique, il faut demander une imagerie par résonance magnétique (IRM) de la tête pour écarter la possibilité d’une neuroschistosomiase.
Le traitement
Il est recommandé de consulter un pédiatre spécialisé en maladies infectieuses ou en maladies tropicales.
Le praziquantel, qui paralyse et tue les vers en quelques heures, est le traitement recommandé. Ses effets indésirables sont généralement légers (nausées transitoires ou malaises). En cas d’infection importante, le traitement peut entraîner une diarrhée sanguinolente transitoire9,10,16. Le praziquantel est efficace chez plus de 90 % des enfants traités. Dans le traitement de la neuroschistosomiase, il faut combiner le praziquantel à des corticoïdes et (peut-être) à des anticonvulsivants, afin d’éviter les exacerbations aiguës après l’extermination des vers ectopiques16.
Il n’existe encore aucun vaccin pour un usage clinique. Voir le tableau 3 pour obtenir de l’information sur le traitement.
Les douves d’origine alimentaires (trématodoses) : les plus « négligés » des vers négligés
Plus de 750 millions de personnes (plus de 10 % de la population mondiale) sont vulnérables à la trématodose, et 56 millions de personnes sont infectées dans plus de 70 pays. L’Asie du Sud-Est et l’Amérique du Sud sont les régions les plus touchées20,21.
Les principales douves (ou trématodes) d’origine alimentaire qui infectent les humains sont les douves biliaires (Opisthorchis viverrini, Clonorchis et Fasciola hepatica), les douves intestinales (Fasciolopsis buskii) et les douves pulmonaires (espèces de Paragonimus). Ces organismes ont tendance à provoquer l’infection chronique de certaines populations, en fonction de la consommation alimentaire de certains types de poisson cru (Clonorchis, Opisthorchis), de crustacés (Paragonimus) ou de plantes aquatiques (F. hepatica) contaminés par des larves au stade infectieux. Les douves biliaires, particulièrement les espèces d’Opisthorchis et le C. sinensis, s’associent à l’apparition de cholangiocarcinomes.
| Figure 5. Œufs de trématode découverts dans des échantillons de selle humaine |
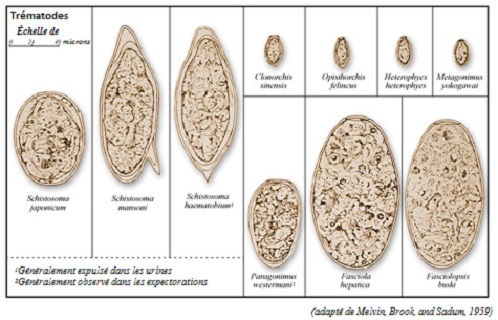 |
| Source : Traduit des Centers for Disease Control and Prevention. Public Heath Image Library (PHIL). Docteure Mae Melvin. |
| Parasite intestinal | Traitement suggéré pour les enfants et les adolescents |
|---|---|
|
Douve |
|
|
Douve du foie de mouton |
|
|
Douve du poumon |
|
|
Schistosomiase (bilharziose) |
|
|
*Non homologué au Canada, mais peut être commandé par l’entremise du Programme d’accès spécial de Santé Canada8,11,12 |
|
Les ténias (cestodes)
L’information liée aux infections par le ténia du bœuf (Taenia saginata) et du porc (Taenia solium) figure dans un autre module du présent site Web. Voir La cysticercose et la téniase.
Lorsque des humains mangent du poisson mal cuit contenant des larves encapsulées, ils sont infectés par la forme adulte du Diphyllobothrium latum, le ténia du poisson. Voir le tableau 4 pour obtenir de l’information sur le traitement.
| Parasite intestinal | Traitement suggéré chez les enfants et les adolescents |
|---|---|
|
Ténia |
|
| H. nana (ténia nain) |
|
| Cysticercose – Voir également La cysticercose et la téniase T. solium (neurocysticercose) |
|
|
Kyste hydatidique (espèces d’Echinococcus) |
|
|
*Voir la référence 22. Le niclosamide (fabriqué par Bayer Pharmaceuticals, Finlande) n’est pas homologué au Canada. Le Programme d’accès spécial de Santé Canada évalue chaque demande. |
|
Le protozoaire ou la coccidie
Une maladie diarrhéique qui dure plus de 14 jours après un séjour dans les tropiques est probablement attribuable à une infection par un parasite protozoaire.
La giardiase, qui se manifeste par une diarrhée aqueuse, une stéatorrhée et une malabsorption, est une infection courante chez les patients d’âge pédiatrique23.
La cryptosporidiose et la cyclosporose se manifestent par une diarrhée aqueuse qui peut être prolongée chez les patients atteints du VIH-sida24,25.
|
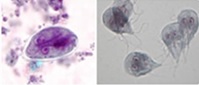
Figure 6. Kyste Giardia et trophozoïtes
Source : Centers for Disease Control and Prevention. DPDx. |
|
Figure 7. Oocystes du Cryptosporidium
Source : Centers for Disease Control and Prevention. DPDx. |
|
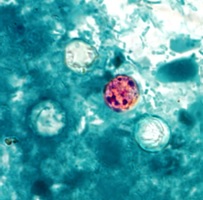
Figure 8. Oocyste de Cyclospora
Source : Centers for Disease Control and Prevention. Public Heath Image Library (PHIL). Melanie Moser. |
|
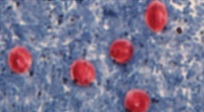
Figure 9. Trophozoïtes d’E. histolytica contenantdes globules rouges ingérés
Source : Centers for Disease Control and Prevention. DPDx. Parasites – Amebiasis |
L’amibiase : On estime que 50 millions d’infections et 100 000 décès sont causés par l’Entamoeba histolytica dans le monde chaque année, particulièrement en Asie, en Afrique subsaharienne, en Amérique centrale et en Amérique du Sud9. Il existe deux espèces similaires sur le plan de la morphologie, mais distinctes sur le plan de la génétique : l’E. histolytica est un parasite responsable de maladies invasives, tandis que l’E. dispar est un parasite commensal non invasif. L’E. histolytica peut se manifester sous forme d’infection intestinale asymptomatique ou de diarrhée sanguinolente (dysenterie), qui peut être chronique et imiter les symptômes d’une maladie inflammatoire de l’intestin. Une petite proportion de patients acquiert la maladie extra-intestinale, généralement dans le foie. À partir du foie, l’E. histolytica peut se répandre dans l’espace pleural, les poumons et le péricarde, de même que dans le cerveau et d’autres régions de l’organisme. La rupture d’un abcès dans le foie, le thorax, le péricarde ou le cerveau peut être mortelle26. Le site Web des CDC présente de l’information, en anglais, sur le cycle de vie de l’Entamoeba histolytica.
Le diagnostic
Le diagnostic présumé d’infection intestinale dépend du dépistage de trophozoïtes (protozoaires actifs) ou de kystes dans les échantillons de selles. Les trophozoïtes qui renferment des globules rouges ingérés sont plus susceptibles d’être des E. histolytica que des E. dispar26. L’immunoenzymologie est utilisée pour le diagnostic sérologique habituel de l’amibiase. Elle permet de déceler les anticorps spécifiques à l’E. histolytica chez environ 95 % des patients atteints d’amibiase extra-intestinale, 70 % des patients atteints d’une infection intestinale active et 10 % des patients asymptomatiques qui expulsent des kystes. L’échographie, la tomodensitométrie et l’IRM peuvent permettre de dépister des abcès au foie ou d’autres foyers d’infection extra-intestinale26.
Les possibilités de traitement de nombreuses maladies parasitaires sont limitées. Il est toujours recommandé de consulter un pédiatre spécialisé en maladies infectieuses ou en médecine tropicale au sujet des patients diagnostiqués qui sont atteints d’une infection gastro-intestinale parasitaire qui exige un traitement antiparasitaire offert par l’entremise du Programme d’accès spécial de Santé Canada. Ils peuvent donner des conseils et des avertissements sur l’utilisation de certains médicaments dans divers groupes d’âge et chez les enfants susceptibles d’être infectés par plusieurs infections parasitaires. Les événements indésirables s’associent également à certains médicaments, particulièrement lorsque l’infection parasitaire touche le système nerveux central.
Les avertissements liés aux médicaments incluent, par exemple :
l’innocuité de l’albendazole n’est pas établie chez les enfants de moins d’un an,
l’innocuité du praziquantel n’est pas établie chez les enfants de moins de quatre ans,
l’innocuité de l’ivermectine n’est pas établie chez les enfants de moins de 15 kg.
| Parasite intestinal | Traitement suggéré pour les enfants ou les adolescents |
|---|---|
|
Amibiase protozoaire |
Infection asymptomatique
En présence de colite ou d’abcès du foie Commencer par 35 mg/kg/jour à 50 mg/kg/jour de métronidazole divisés tid x 10 jours, SUIVIS d’iodoquinol ou de paromomycine, comme il est indiqué ci-dessus, pour éliminer les kystes. |
|
Cryptosporidiose |
|
|
Cyclosporose |
Triméthoprim (TMP)/sulfaméthoxazole (SMX) : 10 mg/kg/jour de TMP et 50 mg/kg/jour de SMX PO divisés bid x 7 à 10 jours |
|
Giardiase |
|
|
Isosporose |
|
|
*Non homologué au Canada, mais peut être commandé par l’entremise du Programme d’accès spécial de Santé Canada8,11,12 |
|
Conclusion
Un document parallèle, intitulé Les parasites gastro-intestinaux : un aperçu, fournit de l’information supplémentaire sur le fardeau des infections et sur la répartition géographique des infections gastro-intestinales parasitaires chez les enfants immigrants et réfugiés. Un dépistage convenable de même que le diagnostic et le traitement rapides des parasites gastro-intestinaux pathogènes chez les jeunes nouveaux arrivants au Canada, peut contribuer à réduire la morbidité et à prévenir les complications.
Quelques ressources
- Australasian Society for Infectious Diseases. Diagnosis, management and prevention of infections in recently arrived refugees. Sydney, NSW: Dreamweaver, 2009.
- Banerji A, Li P, Navaranjan D. The health and nutritional status of new refugee, immigrant, and uninsured children in Toronto, Canada. CERIS, The Ontario Metropolis Centre, résumé de recherche, octobre 2012.
- Boggild AK, Yohanna S, Keystone JS, Kain KC. Prospective analysis of parasitic infections in Canadian travelers and immigrants. J Travel Med 2006;13(3):138-44.
- Bradley JS, Nelson Jd, Kimberlin DW et coll. 2014 Nelson’s Pediatric Antimicrobial Therapy, 20e éd. Elk Grove Village, IL: American Academy of Pediatrics, 2014.
- Centers for Disease Control and Prevention (États-Unis)
- Parasites in children. Mars 2014.
- Neglected tropical diseases. Juin 2011.
- Parasites. Avril 2015.
- Where to find information on parasitic diseases. Mars 2014.
- DPDx – Laboratory identification of parasitic diseases of public health concern. Novembre 2013.
- Intestinal parasite guidelines for domestic medical examination of newly arrived refugees. Novembre 2013.
- Daly R, Chiodini PL. Laboratory investigations and diagnosis of tropical diseases in travelers. Infect Dis Clin North Am 2012;26(3): 803-18.
- Furst T, Keiser J, Utzinger J. Global burden of human foodborne trématodose: A systematic review and meta-analysis. Lancet Infect Dis 2012;12(3):210-21.
- Knopp S, Steinmann, Keiser J, Utzinger J. Nematode infections: Soil-transmitted helminths and trichinella. Inf Dis Clin North Am 2012;26(2):341-58.
- Manganelli L, Berrilli F, Di Cave D et coll. Intestinal parasite infections in immigrant children in the city of Rome, related risk factors and possible impact on nutritional status. Parasit Vectors 2012,5:265.
- Muennig P, Pallin D, Sell RL et coll. The cost effectiveness of strategies for the treatment of intestinal parasites in immigrants. N Engl J Med 1999;340(10):773-9.
- Pickering, LK, Baker CJ, Kimberlin DW et coll., éd. Red Book, 2012 Report of the Committee on Infectious Diseases, 29e édition. Elk Grove, IL: American Academy of Pediatrics: 194-5, 239-40, 333-5, 411-3, 453-4, 532-3, 537, 643-5, 689-90, 731-2, 848-68.
- Sripa B. Global burden of foodborne trematodiasis. Lancet Infect Dis 2012;12(3):171-2.
- Organisation mondiale de la Santé
- Agir pour réduire l’impact mondial des maladies tropicales négligées : premier rapport de l’OMS sur les maladies négligées. 2011.
- Action against worms. Décembre 2007.
- Chimioprévention des helminthiases chez l’homme : Utilisation coordonnée des médicaments anthelminthiques pour les interventions de lutte; Manuel à l’intention des professionnels de la santé et des administrateurs de programmes. 2008.
- Zouré HG, Wanji S, Noma M et coll. The geographic distribution of Loa loa in Africa: Results of large-scale implementation of the Rapid Assessment Procedure for Loiasis (RAPLOA). PLoS Negl Trop Dis 2011;5(6):e1210.
Références
- Géohelminthiases. Aide-mémoire no 366, mai 2015.
- Minnesota Department of Health. Minnesota refugee health provider guide 2013: Parasitic infections.
- Staat MA, Rice M, Donauer S et coll. Intestinal parasite screening in internationally adopted children: Importance of multiple stool specimens. Pediatrics 2011;128(3):e613-22.
- Agence de la santé publique du Canada, CCMTMV. Déclaration sur la diarrhée persistante après un voyage. RMTC, 15 février,2006;32(DCC-1).
- Swanson SJ, Phares CR, Mamo B et coll. Albendazole therapy and enteric parasites in United States-bound refugees. N Engl J Med 2012;366(16):1498-507.
- U.S. Department of Health and Human Services, Centers for Diseases Control and Prevention (National Center for Emerging and Zoonotic Infectious Diseases, Division of Global Migration and Quarantine). Intestinal parasite guidelines for domestic medical examination for newly arrived refugees: Presumptive treatment and screening for strongyloidiasis, schistosomiasis and infections caused by soil-transmitted helminths for refugees. Le 6 novembre 2013.
- Pottie K, Greenaway C, Feightner J et coll. Evidence-based clinical guidelines for immigrants and refugees. Appendix 8: Khan K, Heidebrecht C, Sears J et coll.; Collaboration canadienne pour la santé des immigrants et des réfugiés (CCSIR). Intestinal parasites – Strongyloides and Schistosoma: Evidence review for newly arriving immigrants and refugees.
- American Academy of Pediatrics. Strongyloidiasis (S. stercoralis). In : Pickering LK, Baker CJ, Kimberlin DW et coll., éd. Red Book: 2012 Report of the Committee on Infectious Diseases, 29e éd. Elk Grove Village, IL: AAP, 2012:689-90.
- Cherry JD, Demmler-Harrison GJ, Kaplan SL et coll., éd. Feigin and Cherry’s Textbook of Pediatric Infectious Diseases, 7e éd. Philadelphie, PA: Elsevier, 2014.
- Pottie K, Greenaway C, Feightner J et coll. Evidence-based clinical guidelines for immigrants and refugees. Chapter 10: Intestinal parasites: Strongyloides and Schistosoma. CMAJ 2011; 283(12):E865-8.
- Drugs for parasitic infections. Treatment guidelines from the Medical Letter, Vol.11 (Suppl), 2013:e1-31.
- Bradley JS, Nelson JD, Kimberlin DW, éd. 2014 Nelson’s Pediatric Antimicrobial Therapy, 20e éd., Elk Grove Village, IL: American Academy of Pediatrics, 2014.
- Organisation mondiale de la Santé. Schistosomiase (bilharziose). Aide-mémoire no 115, mai 2015.
- Organisation mondiale de la Santé. Journée mondiale de la Santé 2014 : Prévention des maladies à transmission vectorielle. 2 avril 2014.
- Organisation mondiale de la Santé. 10 faits sur la schistosomiase. Mars 2014.
- Gryseels B. Schistosomiasis. Infect Dis Clin North Am 2012;26 (2):383-97.
- King CH, Dangerfield-Cha M. The unacknowledged impact of chronic schistosomiasis. Chronic Illn 2008;4(1):65-9.
- Organisation mondiale de la Santé. Agir pour réduire l’impact mondial des maladies tropicales négligées : premier rapport de l’OMS sur les maladies négligées. 2011.
- American Academy of Pediatrics. Schistosomiasis. In : Pickering LK, Baker CJ, Kimberlin DW et coll., éd. Red Book: 2012 Report of the Committee on Infectious Diseases, 29e éd. Elk Grove Village, IL: AAP, 2012:643-5.
- Organisation mondiale de la Santé. Trématodoses d’origine alimentaire. Aide-mémoire no 368, mai 2015.
- Organisation mondiale de la Santé. Foodborne trematode infections.
- American Academy of Pediatrics. Other tapeworm infections. In : Pickering LK, Baker CJ, Kimberlin DW et coll., éd. Red Book: 2012 Report of the Committee on Infectious Diseases, 29e éd. Elk Grove Village, IL: AAP, 2012:705-6.
- Wright SG. Protozoan infections of the gastrointestinal tract. Infect Dis Clin North Am 2012;26(2):323-40.
- Harhay MO, Horton J, Olliaro PL. Epidemiology and control of human gastrointestinal parasites in children. Expert Rev Anti Infect Ther 2010;8(2):219-34.
- American Academy of Pediatrics. Cryptosporidiosis and Cyclosporiasis. In : Pickering LK, Baker CJ, Kimberlin DW et coll., éd. Red Book: 2012 Report of the Committee on Infectious Diseases, 29e éd. Elk Grove Village, IL: AAP, 2012:296-300.
- American Academy of Pediatrics. Amebiasis. In : Pickering LK, Baker CJ, Kimberlin DW et coll., éd. Red Book: 2012 Report of the Committee on Infectious Diseases, 29e éd. Elk Grove Village, IL: AAP, 2012:222-5.
Éditeurs scientifiques
Heather Onyett, MD
Mise à jour : mai, 2015